研究内容
中枢疾患医療の未来を拓く中枢関門創薬学の創成
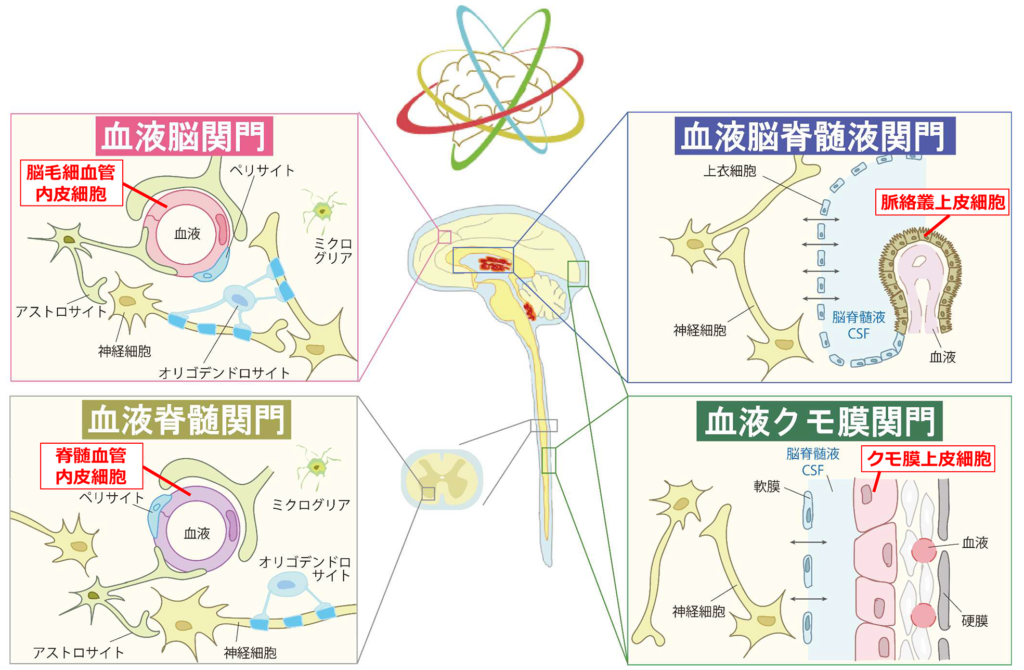
中枢組織には、血液脳関門(BBB)に加えて、血液脳脊髄液関門(BCSFB)、血液クモ膜関門(BAB)および血液脊髄関門(BSCB)の4種類の関門組織が存在し、末梢(血液)と中枢組織内を隔てています。これらをまとめて中枢関門と呼びます。
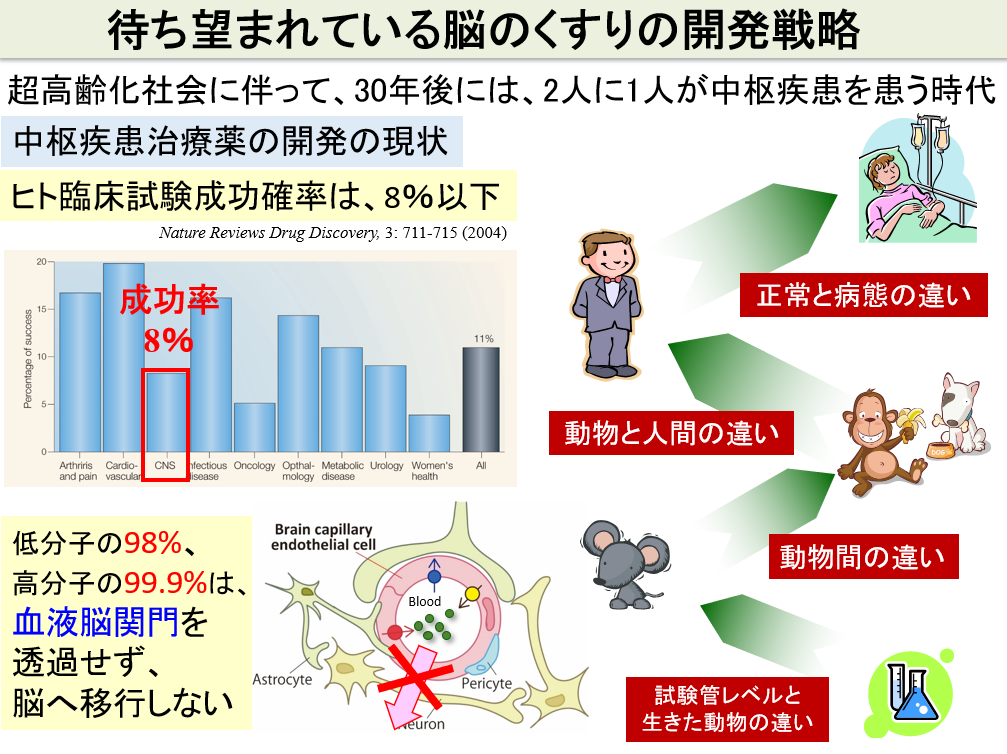
中枢疾患治療薬の新薬開発における課題
①薬の標的となる分子は中枢関門を超えた中枢組織内に存在するという概念が一般的であるため、②薬は中枢関門を通過して中枢組織内へ到達する必要がありますが、99%以上の薬はP糖タンパク(P-gp)などの排出ポンプによって中枢への侵入が妨げられています。③タンパク質・遺伝子やナノ粒子などの高分子に至っては中枢関門を全く通過できません。このように、既存の技術や考え方を今後継続しても、中枢疾患治療薬を効率よく開発できる未来は期待できません。
これに対して、我々は、中枢関門の細胞自体を治療薬・診断薬の標的と捉え、創薬を行うことで、脳移行性の課題を解決し(中枢関門の通過を必要としない創薬)、中枢疾患の新たな創薬フィールドを開拓します。中枢関門は、脳内環境に影響を与えているため、中枢内の病気の重要な原因のひとつとして、関門の異常があげられます(中枢組織内の病態の結果として関門が異常になる場合もあります)。その関門の異常を治療・診断することによって中枢疾患を治療・診断できる、というこれまでにない新しい創薬戦略を確立したいと考えています。以下の4つの構想を具現化していき、新学問「中枢関門創薬学」を創成することを目標に、日々、研究に取り組んでいます。
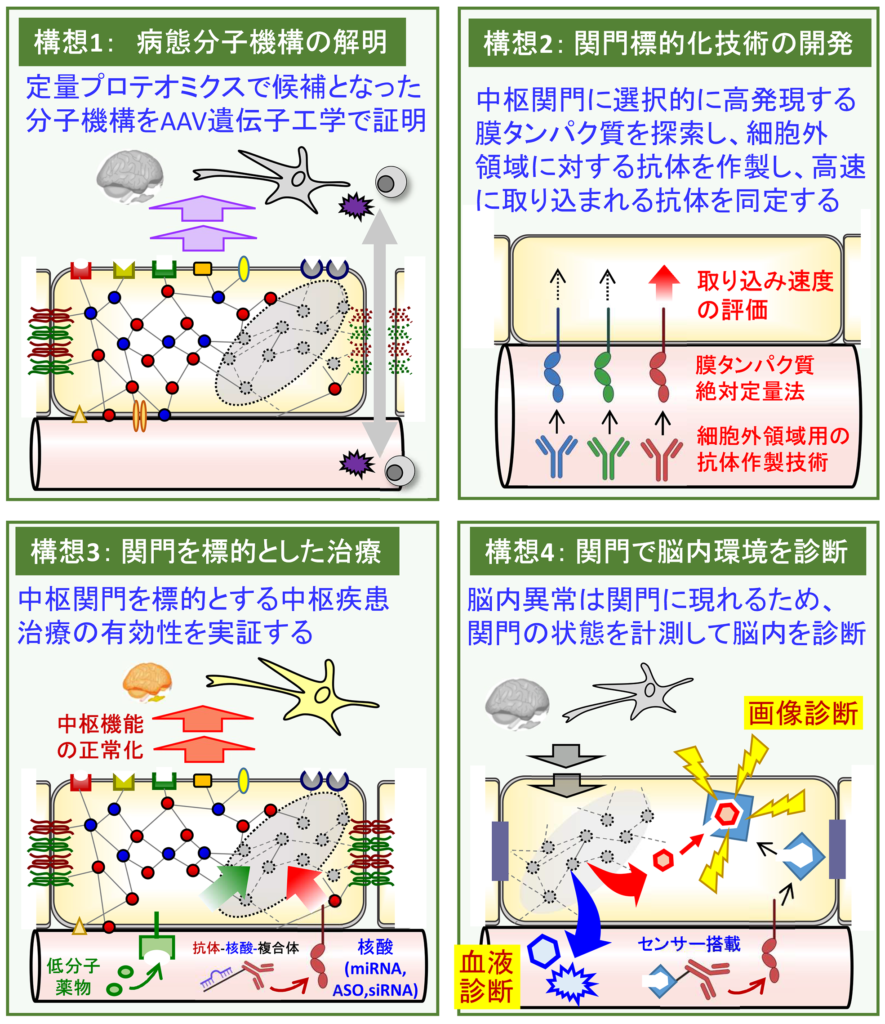
構想1 中枢疾患における中枢関門の病態分子機構を解明し、中枢疾患の発症・進行への寄与を証明します。我々の強みは、マウスに限らず、ヒトの中枢関門の病態分子機構を定量プロテオミクスで解明する技術を保有していることです。特に、ヒトの組織検体は、ホルマリン固定されているため、網羅的な分子機構を定量的に解析することは困難とされてきましたが、我々は、ホルマリン固定パラフィン包埋切片(FFPE)に対する高精度な定量プロテオミクス技術を独自に開発し、脳内の各中枢関門をレーザーマイクロダイセクションで採取して定量プロテオミクス解析を実施しています。定量プロテオミクス解析で候補にあがる責任分子あるいは責任分子機構を、アデノ随伴ウィルス(AAV)を用いたin vivo遺伝子工学技術で中枢関門細胞選択的に発現制御することによって、中枢疾患病態の発症・進行への寄与を証明します。
構想2 他臓器に比べ、中枢関門に、より高発現する膜タンパク質を同定し、抗体を作製し、取り込み速度を評価することによって、それぞれの中枢関門細胞内へ効率よく抗体を送達する技術を確立します。我々の強みは、膜タンパク質の絶対発現量(mole)を網羅的かつ高精度に定量する技術(quantitative Global Absolute Proteomics(qGAP法))を開発している点です。この技術を用いて、中枢関門細胞の血液側細胞膜に局在する膜タンパク質の絶対発現量を網羅的に解明し、他臓器に比べて各中枢関門に選択的に高発現する膜タンパク質を選抜します。候補の膜タンパク質の細胞外領域に対する抗体を作製し、複数の抗体候補の中から、最も高速に中枢関門細胞内へ取り込まれる抗体を同定します。
構想3 中枢関門を標的とする中枢疾患治療の有効性を実証します。我々の強みは、病態分子機構(病態における様々なタンパク質発現量の変化)を正常化できる低分子薬および核酸の配列(miRNA, ASO, siRNA)を予測できる独自のアルゴリズムを開発している点です。例えば、従来の治療用miRNA配列の予測法は、病態時におけるトランスクリプトームデータに基づいて、病態を正常化できると予想されるmiRNA配列を選ぶものでありましたが、タンパク質発現レベルの病態分子機構を十分に正常化することができませんでした。これに対して、我々が開発したアルゴリズム「miR-PAIR法」は、病態に直結するタンパク質群の分子機構を正常化できるmiRNA配列を予測できるものです。これらの技術を用いて、構想1で解明される中枢関門の病態分子機構を正常化できる低分子薬、miRNA、ASO/siRNAを選抜し(核酸は構想2の抗体との複合体を作って)、疾患モデル動物に投与することによって中枢疾患病態を治療できることを実証します。
構想4 中枢関門の状態を計測することによって、脳内環境(中枢疾患)を診断する仕組みを作ります。構想2で開発する抗体にイメージングプローブを修飾し、投与することで、中枢関門内に診断プローブを導入でき、中枢関門の環境を測定することができます。脳内と中枢関門は互いに影響し合う関係であるため、脳内の異常は、中枢関門に現れます。診断プローブによって画像診断する方法に加えて、中枢関門から血液中に漏出する疾患バイオマーカーを血液診断することによって、中枢疾患の新たな診断基盤「中枢関門診断」を確立します。
claudin-5に着目した研究(橋本グループ)
橋本グループでは、内田グループが提唱する4大中枢関門の内、血液脳関門に焦点を当てて研究を行っております。特に、血液脳関門を構成する脳内微小血管内皮細胞に存在する密着結合と、その密着結合を構成するclaudin-5 (CLDN-5) というタンパク質に着目しています。
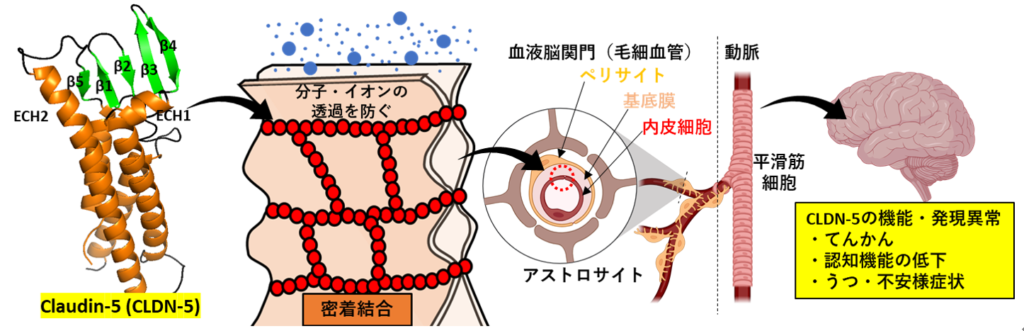
密着結合は、隣り合い、「接着」した上皮細胞や内皮細胞に、物理的に細胞膜が融合する「密着」を形成させます。この「密着」の部分で、分子やイオンの細胞間隙での動きを制限しています。密着結合は、ヒトでは26種類あるCLDN family membersで構成されます。それぞれのCLDNsが、異なる性質の密着結合を作る性質、もしくは、密着結合の形態などを制御する性質を有し、かつ、異なる組織・細胞特異性を持って発現しています。CLDN-5で主に構成される脳内微小血管内皮細胞の密着結合は、分子やイオンの細胞間隙の透過を許容しませんが、CLDN-15を多く含む小腸上皮細胞の密着結合は、陽イオンを透過しやすいという性質を持ちます。これらの密着結合に異常が現れると、組織内の恒常性が乱れ、様々な疾患が現れます。特に、CLDN-5の機能や発現に異常が現れた場合、てんかん、認知機能の低下、うつ・不安様症状などの引き金になります。加えて、これらを含む多くの中枢神経系疾患の慢性度や重症度を間接的に高めることが知られています。グループリーダーの橋本は、世界で初めてヒトで疾患を誘導するCLDN-5の遺伝子変異体を報告【https://doi.org/10.1093/brain/awac215】したり、CLDN-5の機能を中和することができる世界初のCLDN-5に対する抗体の創製【https://doi.org/10.1124/jpet.117.243014】を行ってきたりと、CLDN-5に特化した研究を行ってきております。
橋本グループでは、CLDN-5の「機能」・「発現」の異常を元に戻す「中枢血管の治療」によって、中枢神経系疾患の治療ができるのではないか?を中心テーマに、
- 疾患を引き起こすCLDN-5の中和による「機能」の正常化
- 疾患時にCLDN-5の発現を低下させるように発現上昇する遺伝子の阻害によるCLDN-5の「発現量」の正常化
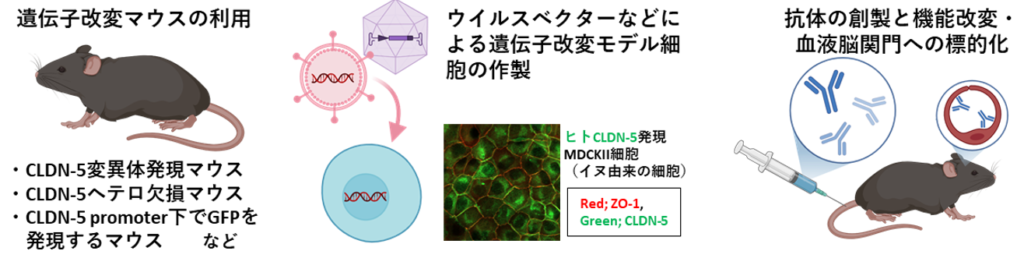
を行っています。これらの研究を、下記実験ツールを使いつつ、国内外の様々な血液脳関門を研究するチームと連携しながら行っていきます。
- 遺伝子改変マウス(モデルマウスやCLDN-5発現血管内皮細胞にGFPを発現するマウス)
- 遺伝子改変モデル細胞(アデノ随伴ウイルスやレトロ様ウイルスを使用した遺伝子の過剰発現、CRISPR/Cas9を使用した遺伝子の欠損)
- 抗体(免疫法による抗体の作製、抗体工学による機能改変。血液脳関門への標的化)
- 血液脳関門模倣系(海外の共同研究者から導入予定。。。)
ヒトの生体内で病気の組織における分子機構を解明するためには、どのようなアプローチが必要か?
創薬研究において、ヒトの生体内で起こっている疾患の分子メカニズムを解明し、それを理解したうえで新薬開発を行うことが王道だと考えられます。しかし、ヒトの病態組織(新鮮、凍結の組織)を十分量入手することは困難です。ホルマリン固定したヒト病態組織(ホルマリン固定パラフィン包埋組織;Formalin Fixed Paraffin Embedded(FFPE)tissue)は医療機関にたくさん保管されており、大変魅力的ではありますが、現状は病理診断の用途に限られており、分子機構の解明の目的には利用できない、などという大きな課題がありました。このため、疾患モデル動物・培養細胞などを用いた実験系が幅広く利用されてきていますが、これらモデルはヒトの真の病態を反映していないという根本的な問題を抱えています。
我々は、直接的にヒトの病態分子機構を解明するためには、ヒトの病態組織を対象とした研究が必須であると考え、医療機関に豊富に保管されている「FFPE組織」の利用が最も有用であると考えました。
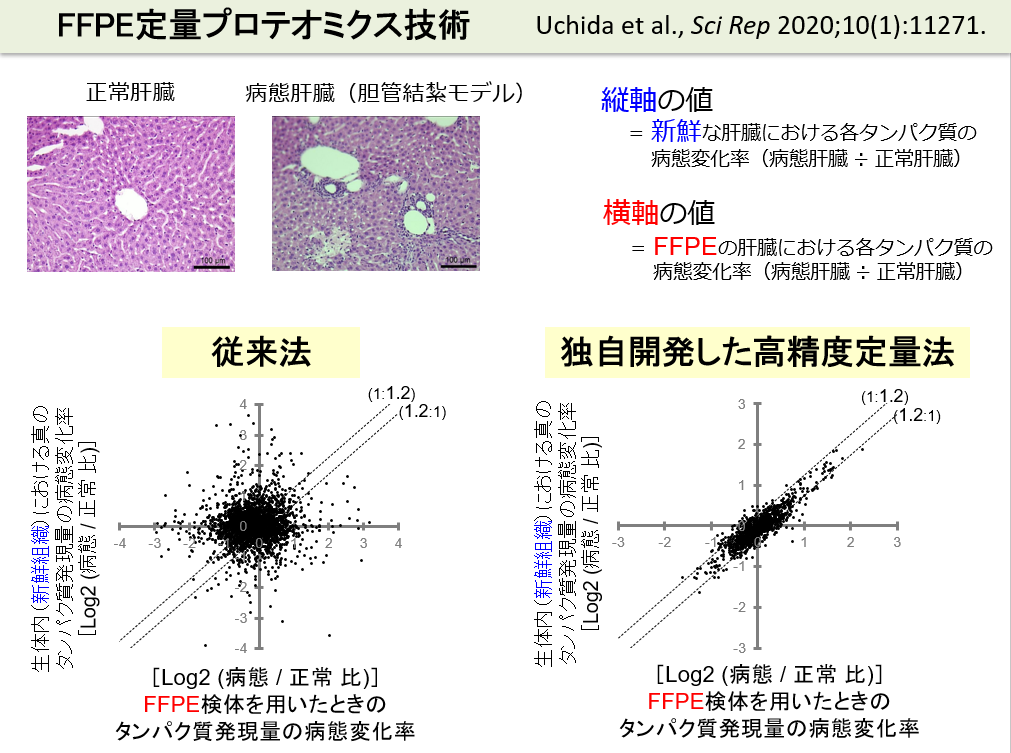
FFPE組織に対してプロテオミクス技術を適用できれば、病態分子機構を解明するための突破口が開かれます。しかし、FFPE組織内では、あらゆる生体分子は、ホルマリン架橋によって互いに密に共有結合しているため、従来法では、FFPE組織から効率よくタンパク質を抽出することは困難でした。これに対して、我々は、超高圧、高温および強力な可溶化剤を組み合わせることによって、FFPE組織から高効率でタンパク質(抽出が困難な膜タンパク質も)を抽出できる方法を開発しました。高精度な網羅的定量プロテオミクス技術(SWATH法)を組み合わせることによって、組織からのタンパク抽出からタンパク質の定量までの一連の過程を高精度化することに成功しました。すなわち、生体内で生じている分子機構をそのまま丸ごと(ロスなく)抽出でき、定量できるようになったため、病態と正常のFFPE組織を用いて得られた各タンパク質の病態変化率(病態/正常比)が、生体内(新鮮組織)の病態変化率を極めて良好に反映するようになりました。下図の従来法のグラフと比べると一目瞭然です。
世界中の医療機関には、膨大な数のFFPE組織が臨床情報と紐づいて保管されています。従って、下図のように、ある疾患について、複数の患者のFFPE組織検体を処理することによって、疾患の分子メカニズムの全容が解明され、新薬開発の新たな標的分子・パスウェイの発見につながると期待されます。また、患者ごとの病態分子機構の診断に基づく、オーダーメイド医療への応用も視野に入れています。
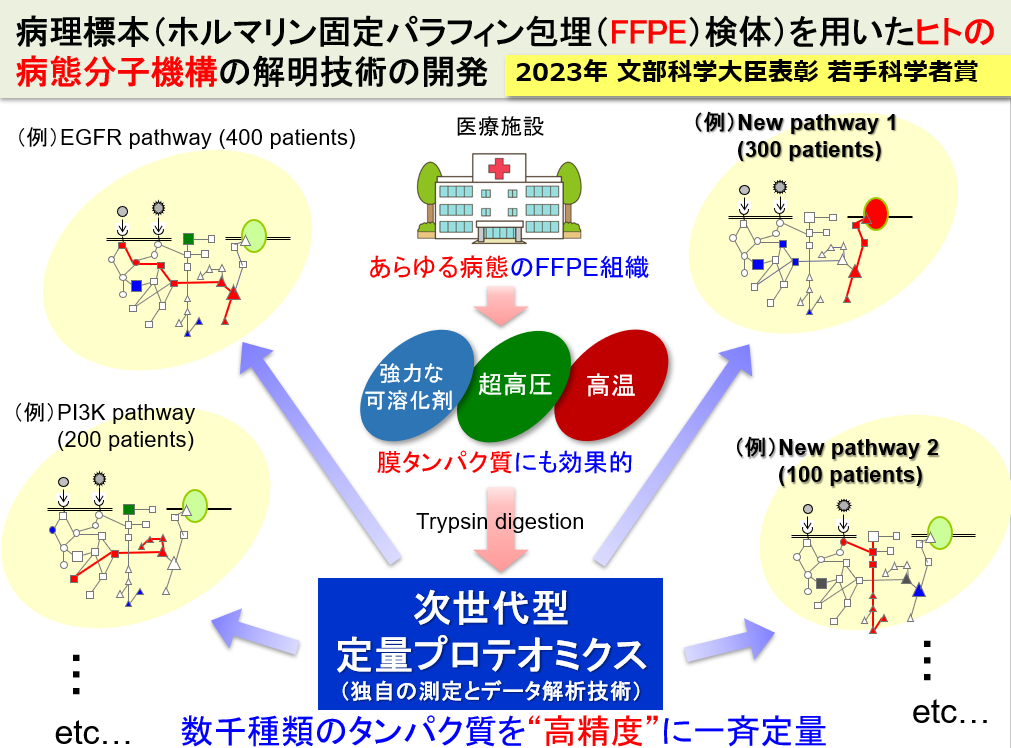
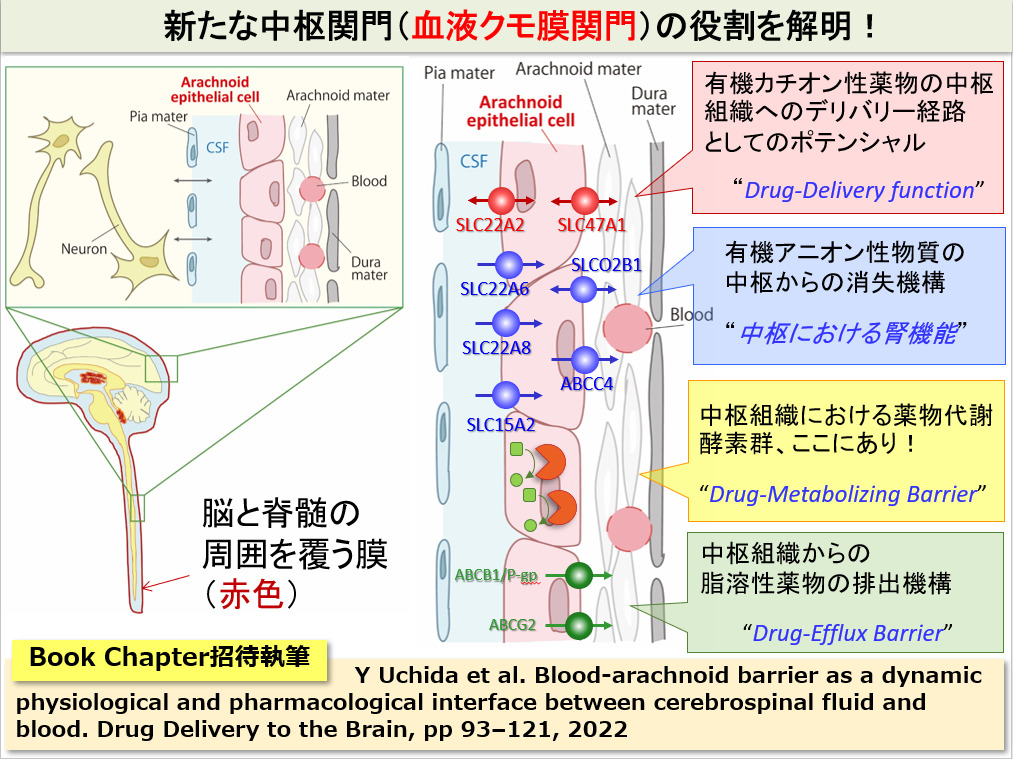
新たな中枢関門(血液クモ膜関門)の役割を解明!
中枢の関門といえば、血液脳関門が良く知られていますが、これ以外にも複数の関門組織が古くから知られています。しかし、その機能や役割は不明なものが多いです。血液クモ膜関門は、中枢組織の外周、具体的には脳脊髄液の外側を覆う関門組織です。実態は、クモ膜上皮細胞(Arachnoid Epithelial Cell)が互いに密着結合を形成することによって、脳脊髄液(中枢)側と循環血液(末梢)側を隔てています。旧来は、単なる物質透過の障壁と考えられてきましたが、我々は、網羅的定量プロテオミクス技術を用いて、この血液クモ膜関門に様々な種類のトランスポーター、受容体や酵素群が発現していることを一挙に解明し、血液クモ膜関門の図に示したような様々な役割をもつユニークな関門であることを示唆しました。ヒトの血液脳関門では、有機カチオン性薬物および有機アニオン性薬物を輸送するトランスポーター群は、軒並み検出限界以下の低い発現量ですが、血液クモ膜関門は図示するようなトランスポーターを高発現しています。また、薬物代謝酵素も豊富であり、中枢の薬物動態を考えるうえでは、無視することができないユニークな関門であると考えて研究に取り組んでいます。
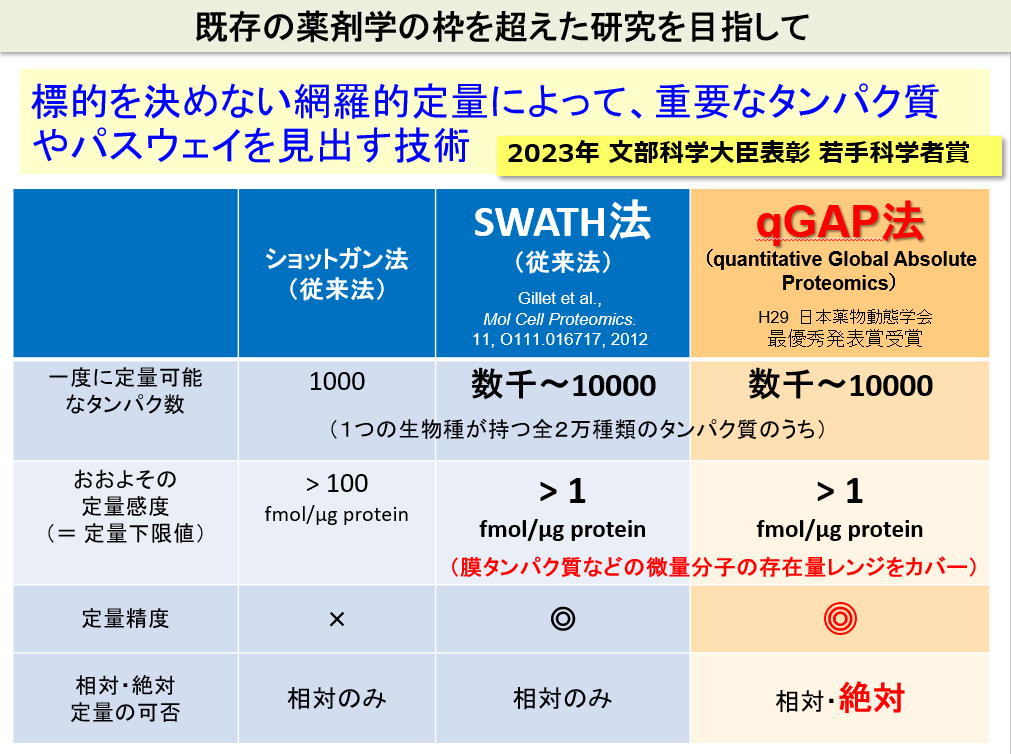
既存の薬剤学の枠を超えた研究を目指して
薬効や薬物動態など、既存の分子では説明できない現象がたくさんあります。従来の既存の分子に焦点を当てる研究では薬学研究の突破口を拓くことはできないと考えられます。未解明の分子機構を解明するための有望な技術として、我々は、網羅的定量プロテオミクス法(網羅的にタンパク質分子を探索し、定量する技術)を用いています。
当研究室で用いている方法の一つであるSWATH法は、従来型のショットガン法に比べて、定量精度が飛躍的に改善し、さらにより少ないタンパク質まで定量することができる技術です。結果として、より多くの種類のタンパク質を高い精度で定量することができます。我々は、独自に、SWATH法を改良し、quantitative Global Absolute Proteomics (qGAP法)を開発しました。通常の網羅的プロテオミクス法は、2群間や複数群間での相対定量(個々のタンパク質の存在量が、ある群に比べて他の群で何倍異なるかを定量する方法)が主流です。qGAP法は、この相対定量に加えて、個々のタンパク質の絶対存在量(mole)を測定することができる点で優れています。
創薬では、病態の組織や細胞においてどのタンパク質やパスウェイが最も有望な創薬標的分子になるかを考えることが重要であり、タンパク質の存在量が大きいほど有望である場合があります。また、薬物動態の観点では、例えば、中枢の関門で高発現するトランスポーターを同定できれば、中枢組織へ薬物を効率よく届けるルートが開かれます。これらの目的に限らず、網羅的に絶対存在量を決めることができる技術は、あらゆるライフサイエンス研究の場において有用であると考えています。
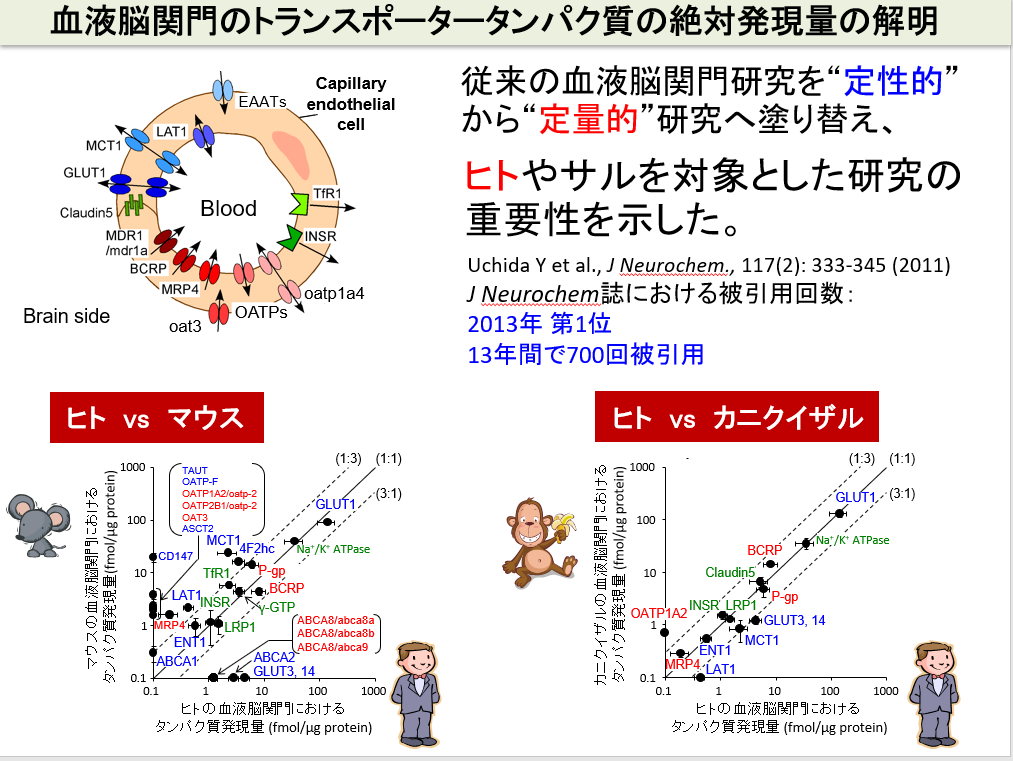
ヒトの脳への薬物移行性を定量的に正確に予測する手法を開発
中枢疾患治療薬のヒト臨床試験における成功確率は、依然として非常に低いです。前臨床試験(実験動物)を通過した候補品の多くが、ヒトでの臨床試験で失敗することを意味しています。その主要な要因の一つが、候補品が、ヒトの血液脳関門を通過しない、あるいは通過しすぎて副作用を生じることがあげられます。我々は、標的絶対定量プロテオミクス(quantitative Targeted Absolute Proteomics, qTAP法)を用いて、ヒトと実験動物の間では、血液脳関門のトランスポーターや受容体分子のタンパク質絶対発現量に大きな違いがあることを見出し、実験動物とヒトの薬物脳移行性の種差の原因を解明してきました。例えば、げっ歯類では、P糖タンパク(P-gp)が最も高発現しており、薬物の脳への移行性を制限していますが、ヒトでは、P-gpよりも、Breast Cancer Resistance Protein(BCRP)という別の排出トランスポーターが高発現していることを明らかにしています。従って、新薬開発において、げっ歯類で得られた薬物脳移行性のデータは、必ずしもヒトの脳移行性予測に適用できないことがわかりました。
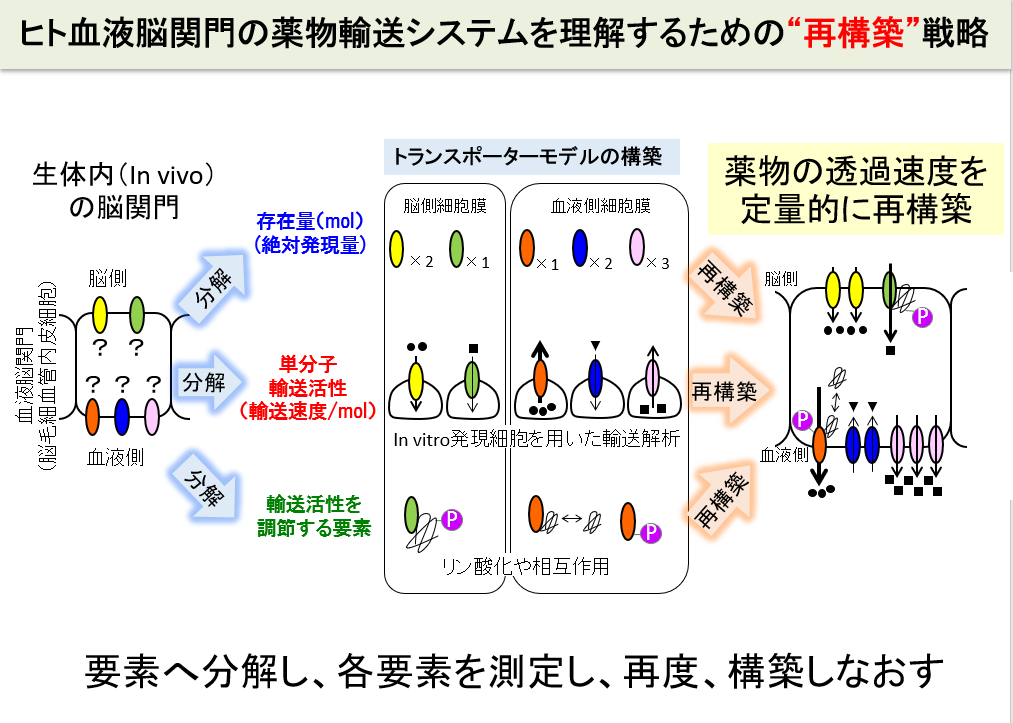
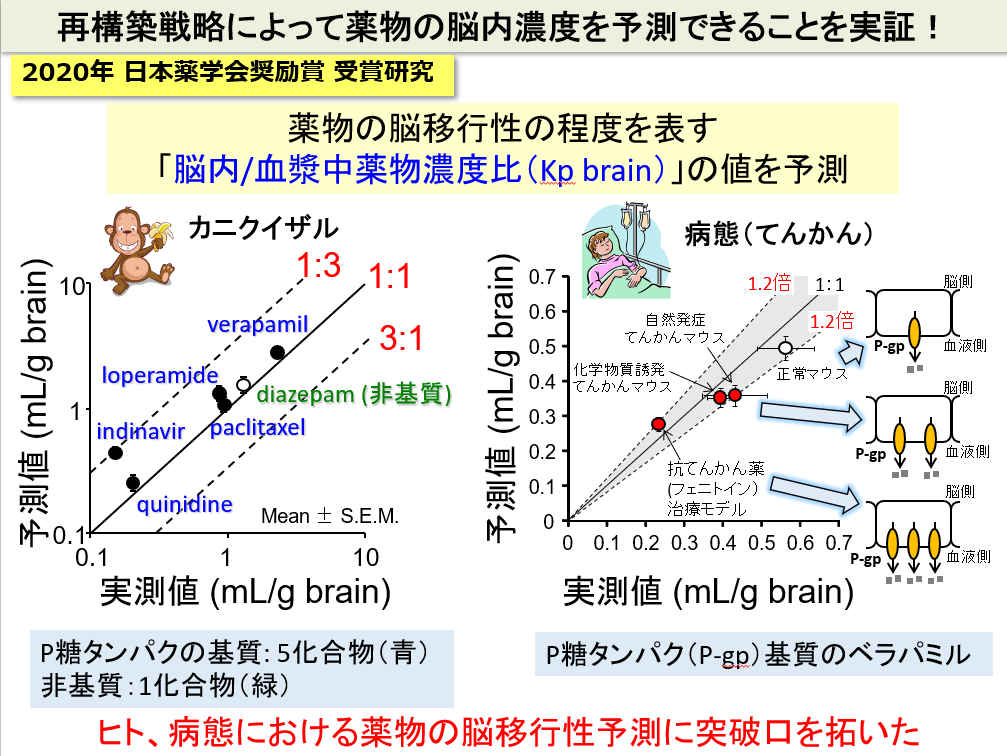
そこで、我々は、ヒトの薬物脳移行性を予測するために、ヒト血液脳関門の輸送システムを要素に分解し、各要素を実験で測定し、再度、構築しなおすことによって理解する戦略をとっています。この「再構築」戦略によって、P-gpに輸送される基質薬物の脳移行性を正確に予測できることを実証しています。特に、ヒトに類似しているカニクイザルで実証できたこと、さらに病態時でも実証できたことから、ヒト、病態における薬物の脳移行性予測に突破口を拓くことができました。